[引言]
關於非金屬的活性比較,往往較少以活性大小分類,而傾向於氧化劑強弱的排列。非金屬的毒性與活性息息相關,但電負度接近並不意味著活性大小相同。以下表格歸納了相關概念,供讀者參考。
表:非金屬相關概念

| 概念 | 定義 | 特性 |
|---|---|---|
| 電子親和力 | 離子化電子時的能量變化 | 放出能量居多 |
| 遊離能 | 原子失去電子所需的能量 | 原子序越大或電子數越少,遊離能越大 |
| 非金屬活性 | 與氧化劑強弱成正比 | 毒性與活性呈正相關 |
| 電負度 | 原子吸引電子的能力 | 不能反映活性大小 |
簡述

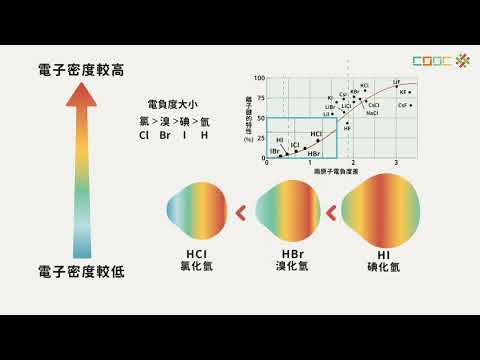
非金屬的活性大小與氧化劑強弱息息相關。電負度相近的非金屬,活性大小不一定相同。電子親和力通常為放熱過程,釋放能量。遊離能則與原子序和電子數有關,原子序越大或電子數越少,遊離能越高。
電負度口訣:指引原子共價鍵強度的秘訣
電負度口訣是學習原子間共價鍵強度的利器,提供了簡潔明瞭的方式來記憶氟、氧、氮、碳、氫五種元素的電負度。
電負度口訣:
氟氧氮碳氫
四三二一零
電負度表格:
| 元素 | 電負度 |
|---|---|
| 氟 (F) | 4.0 |
| 氧 (O) | 3.5 |
| 氮 (N) | 3.0 |
| 碳 (C) | 2.5 |
| 氫 (H) | 2.1 |
電負度概念與共價鍵
電負度代表原子吸引其成鍵電子對的能力。電負度較大的原子會較強地吸引成鍵電子對,形成強的共價鍵。
例如,氟 (F) 和氧 (O) 具有較高的電負度,因此它們之間的共價鍵會比氮 (N) 和氫 (H) 之間的鍵強。
電負度口訣的運用
電負度口訣可幫助我們判斷兩個原子間共價鍵的相對強度:
- 電負度差大:鍵強度強
- 電負度差小:鍵強度弱
- 電負度相同:若為金屬元素,形成金屬鍵;若為非金屬元素,形成非極性共價鍵
範例:
